Objetivo
Separar una mezcla homogenea solida, de dos distintas sustancias.
Antecedentes
¿Como saber como se hace una cristalizacion?
Para poder realizar una cristalizacion debemos saber antes que nada, que es lo que hace una cristalizacion. Bueno una cristalizacion su fin es realizar distintos cristales al rededor del agua para que esto conyeve a la filtracion.
Hipotesis
Con base al punto de ebullicion de la sustancia podemos realizar la cristalizacion.
Material
- Mechero
- Papel filtro
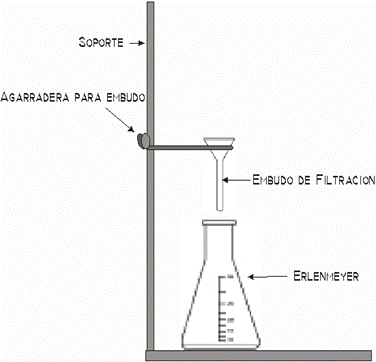
- Embudo conico
- Soporte universal con aro
- Rejilla
- Vaso presipitado de 600 ml
- Bandeja
- Varilla de vidrio
- Sal y azucar
Procedimiento
- Mezclar la azucar y la sal bien
- Vasear esta mezcla con agua suficiente para poder disolverla
- Colocar la rejilla en el aro del soporte universal
- Prender el mechero y colocarlo debajo de la rejilla
- Ya disuelta la mezcla colocar el vaso presipitado arriba de la rejilla
- Dejar que se evapore el agua
- Ya evaporada la mayoria del agua retirar el mechero
- Llena la bandeja con agua fria
- Pasa el vaso presipitado a la bandeja
- Dejar reposar en el agua fria y preparar para la filtracion
- Se filtra el agua para poder obtener los cristales
Obsevaciones
- El agua se evaporo
- En donde se encontraba esta comenzaron a salir cristales al rededor
Conclusiones
Con esta practica pude notar que la cristalizacion se puede llevar acabo cotidianamente en la casa. Es muy importante saberla realizar , la importancia de la cristalizacion es que se pueden separar solidos disueltos en liquidos.
Esta practica es de mucha importancia ya que poco apoco vamos sabiendo que es lo que podemos utilizar para distintos tipos de mezcla